Tất tần tật về quy tắc octet - Cách ứng dụng và những ngoại lệ
- Thanh Mai
- 11 Tháng 4, 2025
Quy tắc Octet là một nguyên tắc quan trọng trong hóa học, giải thích cách các nguyên tử tương tác với nhau để đạt được cấu hình electron ổn định. Theo quy tắc này, các nguyên tử có xu hướng tạo liên kết sao cho lớp vỏ ngoài cùng của chúng chứa đủ tám electron, giúp chúng có cấu trúc bền vững như các khí hiếm. Việc hiểu rõ quy tắc Octet sẽ giúp bạn nắm vững hơn cách hình thành các liên kết hóa học và dự đoán tính chất của các hợp chất.
Quy tắc Octet là gì?
Quy tắc octet chỉ ra rằng các nguyên tử ổn định nhất khi lớp vỏ hóa trị của chúng được lấp đầy bằng tám electron. Quy tắc này dựa trên quan sát rằng các nguyên tử của các nguyên tố nhóm chính có xu hướng tham gia vào liên kết hóa học theo cách mà mỗi nguyên tử của phân tử kết quả có tám electron trong lớp vỏ hóa trị. Quy tắc octet chỉ áp dụng cho các nguyên tố nhóm chính.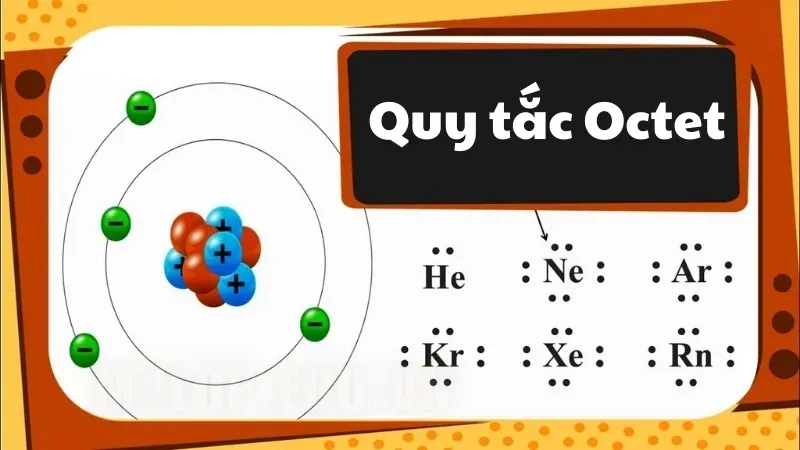
Các phân tử halogen, oxy, nitơ và cacbon được biết là tuân theo quy tắc octet. Nhìn chung, các nguyên tố tuân theo quy tắc này bao gồm các nguyên tố khối s và các nguyên tố khối p (trừ hydro, heli và liti).
Quy tắc bát tử có thể được quan sát thấy trong liên kết giữa các nguyên tử cacbon và oxy trong phân tử cacbon dioxit, như minh họa qua cấu trúc chấm Lewis bên dưới.
Giải thích chi tiết quy tắc Octet
Các electron chung đáp ứng các yêu cầu về hóa trị của cả hai nguyên tử liên kết. Do đó, có thể thấy rằng cả nguyên tử oxy và nguyên tử cacbon đều có cấu hình octet trong phân tử CO2 .
Khi quan sát thấy các khí hiếm trơ về mặt hóa học, nhà vật lý người Đức Walther Kossel và nhà hóa học người Mỹ Gilbert Lewis đã đề xuất lý thuyết điện tử về hóa trị. Lý thuyết này dựa trên xu hướng các nguyên tử đạt đến trạng thái ổn định nhất có thể.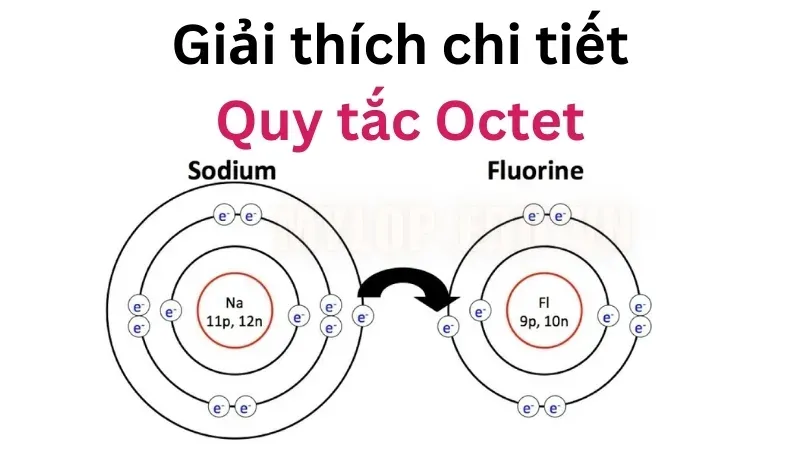
Ví dụ chi tiết về quy tắc Octet
Một số ví dụ chi tiết về liên kết hóa học của các nguyên tử tuân theo quy tắc bát tử có thể được tìm thấy trong tiểu mục này.
NaCl (Natri Clorua)
+) Hợp chất này có liên kết ion giữa ion natri (Na + ) và ion clorua có độ âm điện (Cl – ).
+) Nguyên tử clo có 7 electron trong lớp hóa trị của nó và có thể đạt được cấu hình octet bằng cách nhận thêm một electron.
+) Lớp vỏ ngoài cùng của natri có một electron. Nếu mất electron này, lớp vỏ thứ hai sẽ trở thành lớp vỏ hóa trị (đã được lấp đầy bằng 8 electron). Do đó, ion Na + bền hơn natri kim loại.
+) Cation natri và anion clorua lúc này tạo thành liên kết ion và phân tử kết quả có cấu hình octet cho cả hai nguyên tử tham gia.
MgO (Magiê oxit)
+) Liên kết giữa magie và oxy trong magie oxit có bản chất là liên kết ion.
+) Nguyên tử magiê dễ dàng mất hai electron để có được cấu hình electron ổn định của neon. Điều này dẫn đến sự hình thành Mg 2+
+) Tương tự như vậy, oxy nhận được hai electron để tạo thành O 2-
+) Lực hút tĩnh điện phát sinh giữa hai ion này dẫn đến sự hình thành liên kết ion giữa chúng.
+) Cả hai nguyên tử trong phân tử MgO đều có cấu hình octet ổn định.
Những hạn chế của Quy tắc Octet
Không phải tất cả các nguyên tố hoặc phân tử đều tuân theo lý thuyết octet về hóa trị. Có một số hạn chế đối với quy tắc octet ngăn cản tất cả các nguyên tố hoặc phân tử tuân theo nó. Những hạn chế này được đưa ra dưới đây:
Một ion, nguyên tử hoặc phân tử chứa một electron hóa trị không ghép đôi được gọi là gốc tự do vi phạm quy tắc octet. Tuy nhiên, các gốc tự do rất không ổn định và có xu hướng tự động tạo thành dimer.
Vì lớp vỏ đầu tiên, tức là lớp vỏ trong cùng, chỉ có thể hỗ trợ hai electron, nên các nguyên tố như heli (He), liti (Li) và hiđrô (H) tuân theo quy tắc song ca, tức là quy tắc hai, thay vì quy tắc bát tử. Ví dụ, Li có thể loại bỏ một electron để có cấu hình an toàn dẫn đến lớp vỏ cuối cùng gồm hai electron.
Các nguyên tố chuyển tiếp không tuân theo quy tắc octet. Đó là do sự hiện diện của một orbital d. Các lớp ngoài cùng của các nguyên tử này có thể chứa tới 18 electron.
Hợp chất thơm đòi hỏi sự phi định xứ của các electron pi. Thay vì tuân theo quy tắc octet, các electron này tuân theo quy tắc Huckel.
Có một số phân tử thiếu electron, chẳng hạn như boran và carborane. Các phân tử này tuân theo quy tắc của Wade để đạt được sự ổn định. Các phân tử này có liên kết ba tâm hoặc liên kết chuối trong đó ba nguyên tử tách hai electron.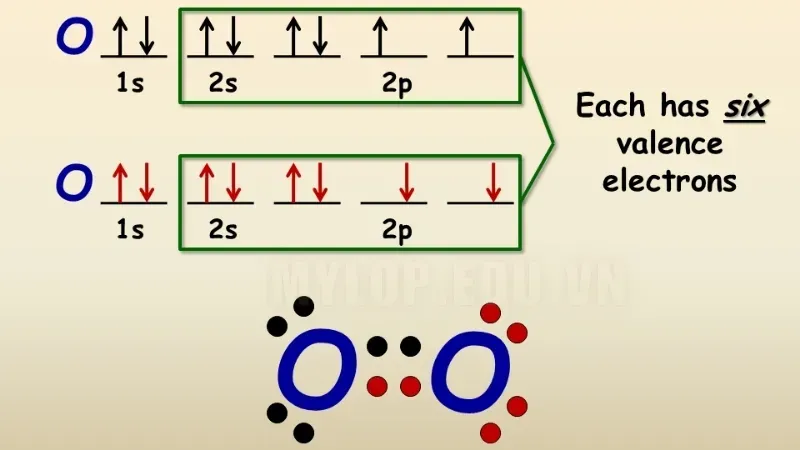
Quy tắc Octet là nền tảng giúp chúng ta hiểu rõ hơn về tính chất hóa học và cấu trúc của nhiều hợp chất. Tuy có một số trường hợp ngoại lệ, nhưng nguyên tắc này vẫn được áp dụng rộng rãi để giải thích cách các nguyên tử tương tác và liên kết với nhau. Hãy đảm bảo rằng bạn nắm vững quy tắc Octet để có cái nhìn toàn diện hơn về hóa học cơ bản và nâng cao.
Tags:
Thanh Mai
Tác giả Thanh Mai đã có hơn 20 năm nghiên cứu và tìm hiểu về những lĩnh vực trong đời sống. Với kiến thức rộng mở, bà luôn muốn chia sẻ với tất cả mọi người giúp độc giả hiểu rõ hơn về bản thân và những người xung quanh.
Tìm Kiếm
Bài Viết Liên Quan
Cách thực hiện quy tắc ăn ngược giúp giảm cân trong 1 tuần đầu
- 11 Tháng 4, 2025
Quy tắc ăn uống hỗ trợ giảm cân bền vững, tránh tăng cân trở lại
- 11 Tháng 4, 2025
Bật mí chiến thuật cùng quy tắc chơi ô ăn quan hiệu quả
- 11 Tháng 4, 2025
Làm thế nào để tuân thủ quy tắc ăn chay mà vẫn đủ dinh dưỡng?
- 11 Tháng 4, 2025
Bài Viết Mới
Tiểu sử Tô Lâm và hành trình xây dựng bộ máy nhà nước
- 24 Tháng 2, 2026
Cách dưỡng da bằng nha đam trắng mịn tôi đã kiểm chứng
- 24 Tháng 2, 2026
Bí kíp review cách trị gàu tận gốc hiệu quả sau 7 ngày ngay
- 23 Tháng 2, 2026
Mẹo chữa rụng tóc sau sinh phục hồi chân tóc yếu ngay
- 13 Tháng 2, 2026






Bình Luận